上海奥法美嘉生物科技有限公司代理商
10 年
手机商铺
- NaN
- 0.5
- 0.5
- 2.5
- 2.5
推荐产品
公司新闻/正文
复杂制剂应用专题 | AccuSizer在疫苗研发与质控中的应用:亚可见颗粒的精准检测
17 人阅读发布时间:2026-01-27 16:20
一、疫苗及颗粒概述
1.1 疫苗的类型
疫苗是一类用于预防感染性疾病的生物制品,其通过激发机体特异性免疫应答获得免疫保护。按照制备原理的不同,常见的疫苗类型包括:
-
灭活疫苗:通过化学或物理方法灭活病原体,如灭活流感疫苗
-
减毒活疫苗:通过削弱病原体毒力制备,如麻疹疫苗
-
重组蛋白疫苗:利用重组技术表达特定抗原蛋白,如乙型肝炎疫苗
-
核酸疫苗:基于mRNA或DNA表达抗原蛋白,如部分新冠疫苗
不同类型疫苗中蛋白质含量、辅料成分和佐剂配比差异明显,这直接影响颗粒形成和分布特性。
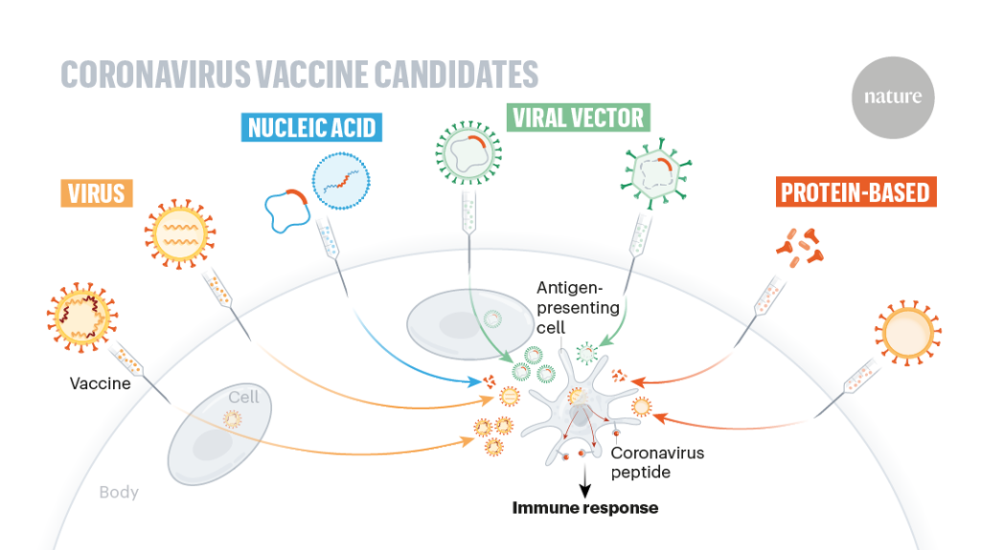
图1:疫苗类型示意图[1]
1.2 疫苗中颗粒的来源
疫苗中的颗粒来源复杂,可依据不同划分原则进行分类。按粒径范围,通常分为可见颗粒与亚可见颗粒;按来源,则可分为内源性颗粒与外源性颗粒。
1.2.1 内源性颗粒
内源性颗粒主要源于疫苗配方自身成分的理化变化。典型例子有蛋白质聚集体和乳化剂颗粒。
1.2.1.1蛋白质聚集体
蛋白质类疫苗在生产、运输及储存过程中极易受到物理、化学因素的影响,如温度波动、冻融循环以及pH变化等。这些应激条件会导致蛋白质分子部分折叠或发生不可逆聚集,进而形成不同尺寸范围的亚可见颗粒(subvisible particles, SVPs)[2,3]。如图2展示了蛋白质在受到外界因素影响时,其结构变化形成蛋白质聚集体的过程。从初始的折叠、有序的蛋白质结构开始,经过一系列中间状态,最终形成不同形式的聚集体。这一过程直观地呈现了蛋白质类疫苗在不利环境下可能发生的结构改变,这些改变正是导致颗粒形成的原因。研究表明,这类颗粒不仅会降低疫苗制剂的长期稳定性,还可能增强其免疫原性,诱导机体产生非预期的免疫反应甚至免疫原性相关不良事件[4]。这些颗粒可能引起免疫原性增加或降低疫苗稳定性,对其进行有效监测和表征对于保证疫苗的安全性和疗效至关重要。
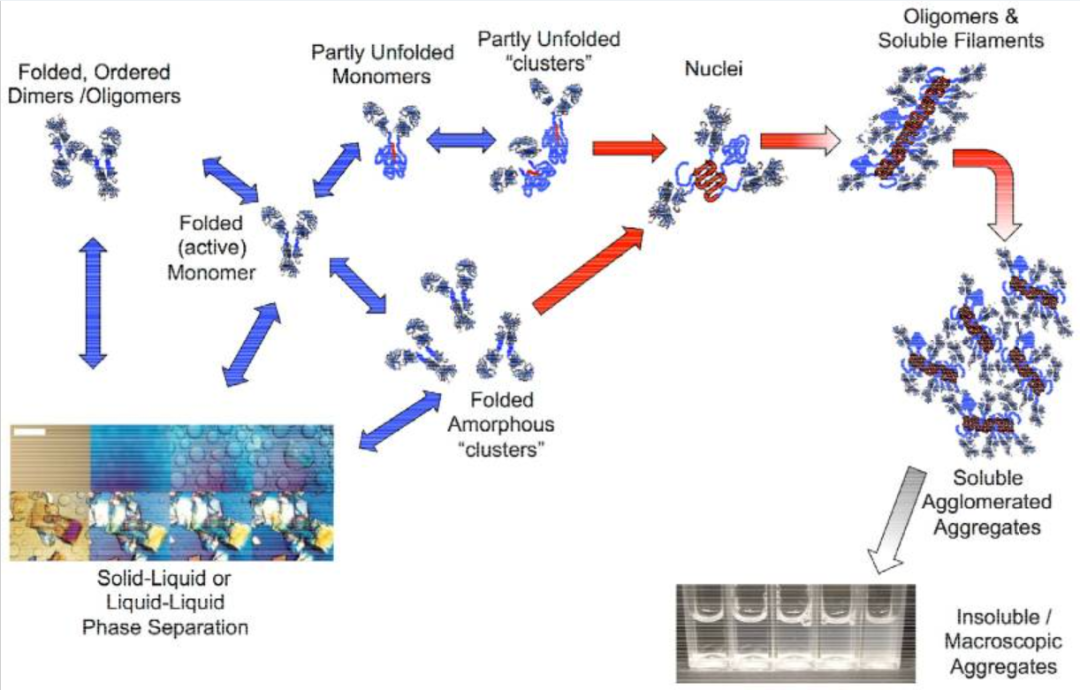
图2:蛋白质不同聚集状态的示意图
1.2.1.2 乳化剂颗粒
油包水乳液型佐剂(如MF59、AS03)中的乳剂颗粒本身属于功能性成分,通常处于亚微米级别,对疫苗的免疫增强效果具有重要作用。然而,在贮存或运输过程中,乳剂颗粒可能发生聚集或粒径异常增大,形成亚可见或不溶性大颗粒,进而影响制剂的物理稳定性与用药安全性。若颗粒过大,易导致乳剂分层、聚集,并增加注射部位的不良反应风险;而颗粒尺寸若偏离预期范围过小,则可能引起体内快速清除或免疫应答不足,均会削弱疫苗的有效性与安全性。
以诺华乳佐剂专利(WO2011067669A2)为例,其中明确指出需对粒径在1.2 μm以上的颗粒进行监控与定量分析,并制定了相应的测量标准。该专利采用AccuSizer系列颗粒计数器进行检测,正是基于对大颗粒影响乳剂稳定性的考量。此类大颗粒的存在可能加剧聚集与分层现象,从而影响佐剂免疫效果的一致性与安全性[5]。该实例表明,AccuSizer在乳剂体系中对亚可见及不溶性大颗粒的高精度监测具有明确的应用价值。

图3:诺华乳佐剂专利
1.2.2 外源性微粒
疫苗中的外源性微粒来源复杂,可能在生产、包装、运输、储存、开启及临床使用的各个环节被引入。这进一步强调了严格控制微粒污染的必要性,以及在药品包装设计、操作流程规范和终端临床使用中采取系统性风险控制措施的重要性。
图4:可能引入外源性微粒途径示意图
案例分享:安瓿瓶不同打开方式与药品微粒含量实验及其结果;该实验设置了三种不同的安瓿瓶打开方式作为研究变量,分别Our Method、常General Method以及Open adaptor。实验过程中,严格遵循标准操作流程,实验结果通过柱状图清晰呈现。
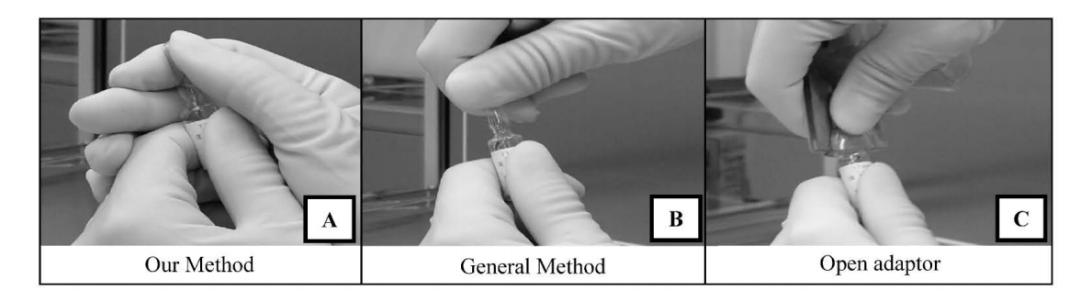
图5:安瓿瓶不同打开方式操作示意图
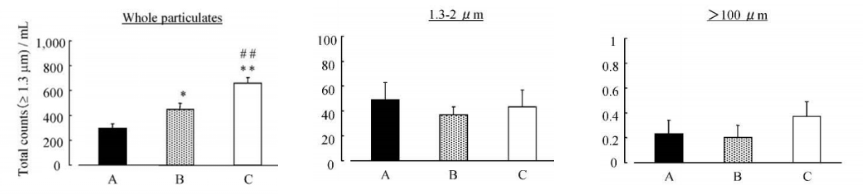
图6:安瓿瓶A、B、C三种打开方式药品微粒含量对比
从图示结果可以看出,安瓿瓶玻璃在受力断裂时,无论是使用开瓶器还是直接用手掰开安瓿瓶,都会在开启过程中产生数量不等的微粒。
这些外源颗粒的存在给疫苗注射安全埋下了隐患,可能致使接种部位出现刺激症状、引发炎症等不良后果。[6]
二、为什么需要关注疫苗中的颗粒
2.1. 对健康与免疫的影响
健康风险是疫苗安全性关注的核心。研究表明,疫苗用辅料(如蔗糖)中若存在不溶性微粒,可能激发异常的免疫应答。例如,基于小鼠腘窝淋巴结模型的实验显示,蔗糖中的不溶性微粒可引发免疫反应,提示在疫苗辅料的质量控制中需重视不溶性微粒的合理管控。[6]
正常情况下,疫苗注射后机体会产生预期的免疫应答并伴随一些轻微、正常的生理反应,但也可能出现异常情况。图7直观对比疫苗注射后机体的正常反应与异常反应:左侧显示注射后局部组织无异常炎症表现,仅产生预期免疫应答和组织相关的轻微、正常生理反应;右侧显示可能会产生的血管栓塞风险、组织反应异常、过敏反应等伴随的异常病理反应。
随着微粒进入机体循环,还可能引起更大的全身健康风险,如图8所示。[7]
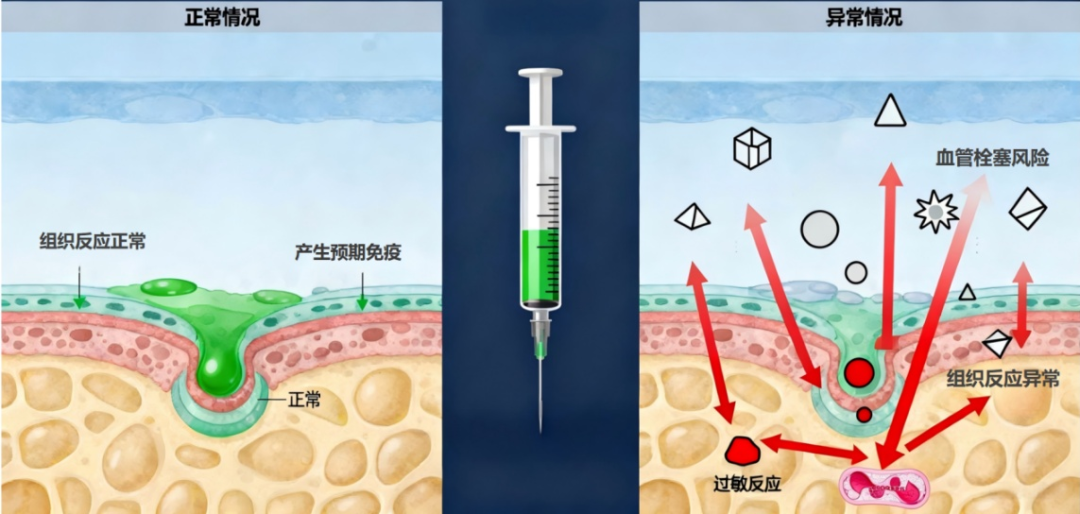
图7:注射疫苗免疫反应对比图
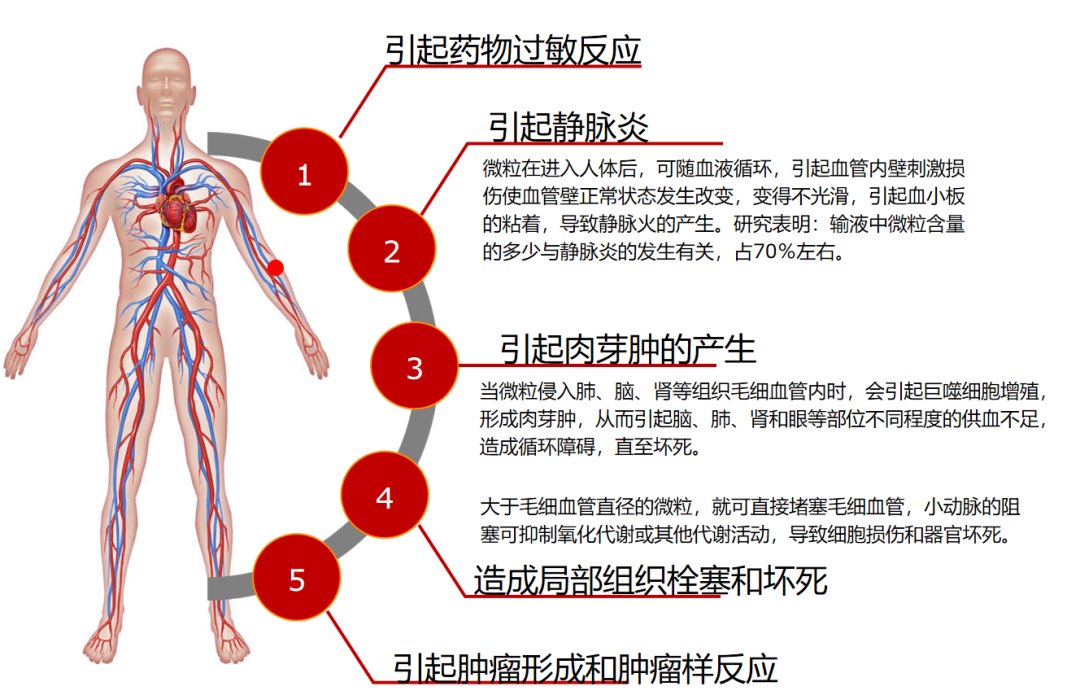
图8:微粒引起健康风险图示
2.2 疫苗有效性与制剂稳定性
疫苗中含有多种成分,其中不少是以蛋白质为基础的物质,抗原便是典型的蛋白质成分。在疫苗的研发、生产和储存过程中,由于各种因素(如温度变化、pH 值波动、机械应力等)的影响,抗原蛋白质可能会发生聚集现象。蛋白质聚集可能改变抗原构象,降低疫苗诱导的特异性免疫应答。乳化剂颗粒分布不均则可能导致佐剂作用不稳定,影响免疫增强效果。[8]
如图9所示:左侧展示了典型的Y形抗体分子结构,正常情况下,其两个臂端可与特定抗原实现特异性结合,这是启动正常免疫应答的关键步骤。然而,右侧呈现了抗原发生蛋白聚集后的状态,大量抗原聚集形成较大的聚集体。这种聚集改变了抗原的原有结构和表位暴露情况,导致抗体无法与聚集后的抗原进行有效结合。一旦无法实现特异性结合,正常的免疫应答过程便无法启动,在疫苗应用的情境下,也就意味着疫苗无法发挥预期的免疫效果,影响了其保护机体免受相应病原体侵害的能力。因此,对亚可见颗粒进行精确监控是保证疫苗免疫效果的关键环节。
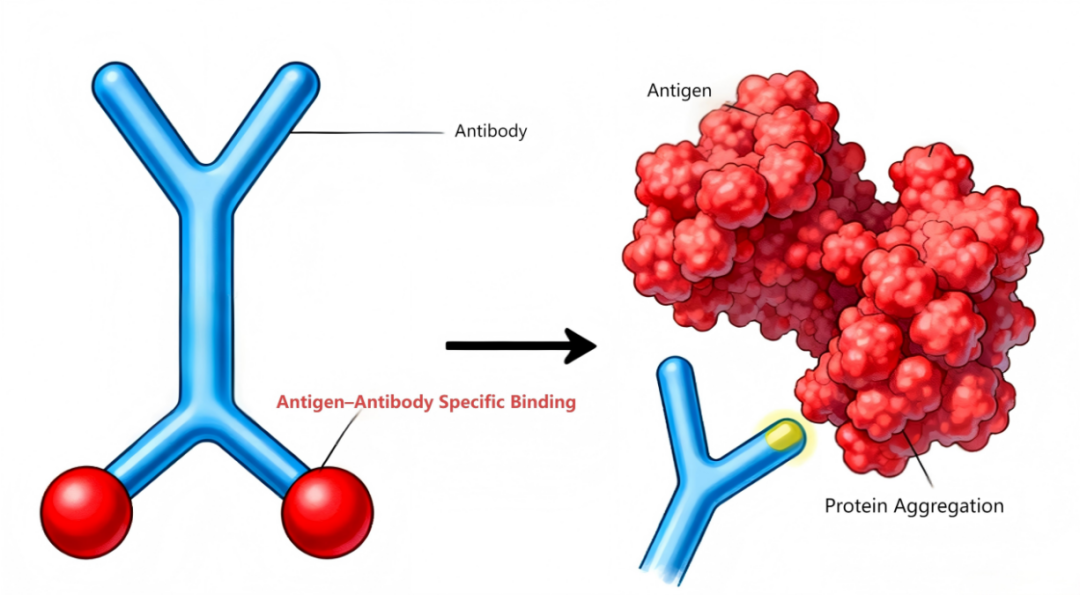
图9:抗原抗体正常特异性结合及蛋白聚集导致的异常结合示意图
2.3 监管需求
疫苗投入市场前,企业完成全部检验项目后,必须由国家药品监管部门对每批疫苗的质量进行严格审核、检验。企业的质量自检旨在确保疫苗的安全、有效、合规,涵盖从原料到成品的每个环节,通过严格的质量控制,保障疫苗质量符合国家标准。[9]
我国自 2006 年开始对进口 MMR 制品实行批签发全检,2008 年开始对国产 MMR 制品实行批签发资料审核与实验室项目部分检定。中国无进口MMR 制品后,国产 MMR 疫苗的批签发数量明显增加,见图10。[10]
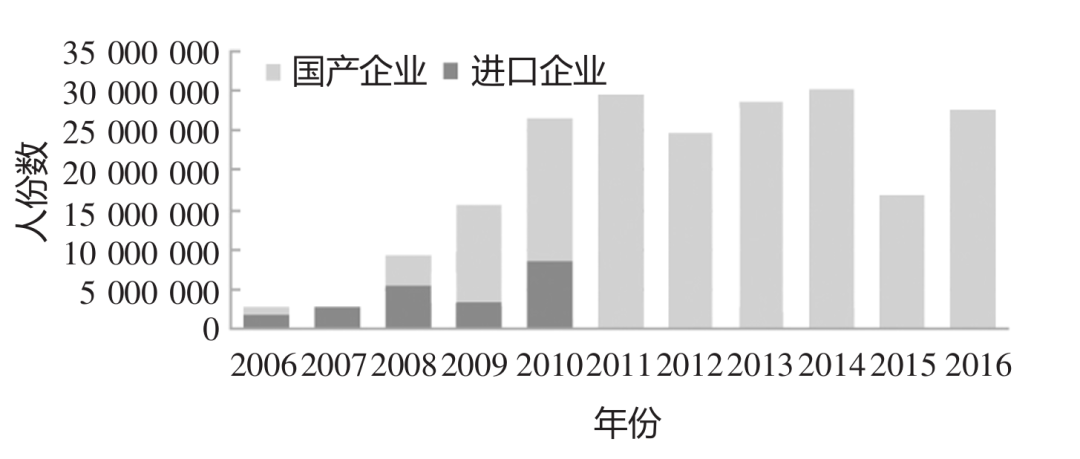
图 10:2006~2016 年间 MMR 疫苗批签发人份数统计
疫苗产量的大规模提升对疫苗的质量提出了严峻的考验,维持疫苗的批间稳定性与一致性是保证疫苗有效性与安全性的关键。
2.4 法规要求
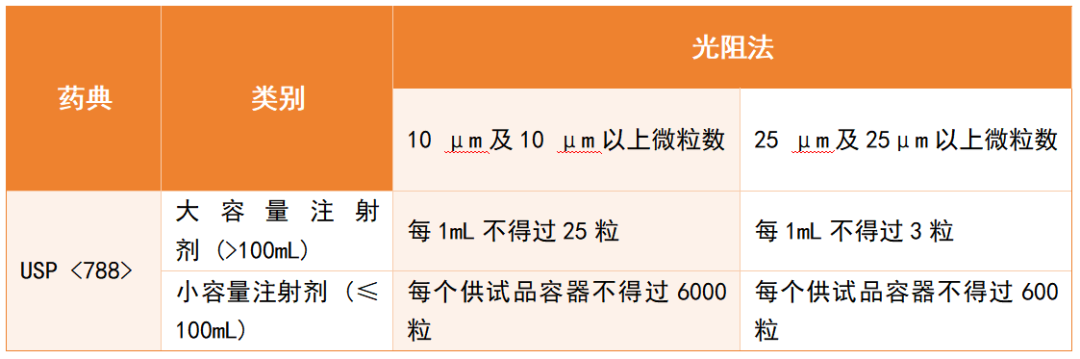
各国药典对注射剂中的微粒均有严格要求,但检测范围和限值存在差异。以注射剂中不溶性微粒为例:美国药典USP <788> 对注射剂≥10 μm和≥25 μm的颗粒设定了明确限值,见表格1。中国药典(ChP):对不溶性微粒的检测范围相对较窄,主要针对部分常规注射剂,对特定类型疫苗或含佐剂的复杂制剂尚未完全涵盖。虽药典规定的“不溶性微粒”检测仅覆盖部分注射制剂,并非涵盖所有类型的疫苗;但在疫苗研发与质量控制实践中,企业已普遍将微粒监测纳入关键检测项目。这一趋势正好反映了从“科学风险”到“法规要求”的转化过程。[11][12]
表格1:USP <788>关于注射剂规定
三、疫苗颗粒检测的难点
疫苗颗粒的物理化学特性会影响其稳定性、免疫原性和安全性。然而,疫苗制剂中颗粒体系的复杂性以及检测环境的敏感性使得精准表征疫苗颗粒面临多重技术挑战。以下从颗粒来源、浓度、配方干扰及样品制备四个维度,分析疫苗颗粒检测的难点。
3.1 颗粒来源复杂
疫苗制剂中颗粒来源多样,可分为内源性颗粒和外源性颗粒两大类。不同来源的颗粒可能具有相似的粒径或光学特性,但其潜在风险截然不同。这对检测仪器的分辨率、检测原理的针对性以及数据分析能力提出了极高要求。
3.2 样品有限下的微量颗粒检测难
在疫苗研发阶段,可用于颗粒检测的样品通常非常有限,尤其是临床前或早期研发样品,无法进行大规模取样。这就对检测仪器提出了高要求:必须具备高灵敏度、低样品消耗和精确量化能力,才能在微量样品条件下准确监测颗粒,避免漏检或误判。
3.3 配方干扰
高蛋白浓度、盐类或乳化剂可能影响光学或阻抗检测信号,导致假阳性或假阴性结果,给检测带来挑战。
3.4 样品制备易改变颗粒状态
稀释、搅拌或温度变化可能导致颗粒聚集或解聚,影响测量结果的准确性。因此,减少样品制备干扰是确保检测可靠性的关键。
四、AccuSizer在疫苗颗粒检测中的优势
疫苗颗粒检测面临多重挑战,包括颗粒微小、浓度低、来源复杂、配方干扰以及法规要求严格。AccuSizer颗粒计数器在应对这些难点时具有多方面优势,可以分为以下几点:
4.1 微量进样
疫苗样品在研发、生产及质量控制过程中,有时可获取的样品体积较小。AccuSizer灵敏度高达10PPT级别,即使只有微量的颗粒通过传感器,也可以精准检测出来。确保即使在样品量有限的情况下,也能全面评估疫苗的安全性和稳定性,避免因漏检微量颗粒而影响疫苗质量
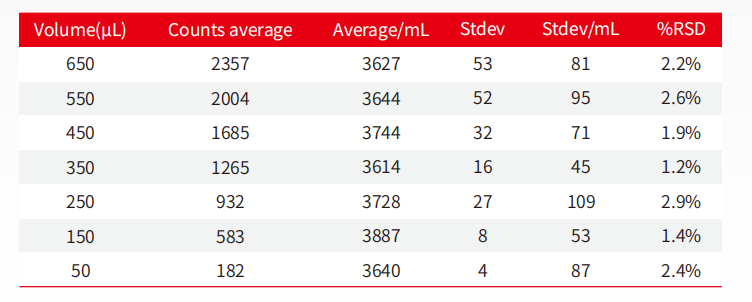
图11:微量进样不同体积精确性对比表
新版药典USP<787>对于体积精度提出了苛刻的要求。AccuSizer 系列仪器对进样体积、流速及计数准确性分辨率经过严格验证,最小的进样量可达50μL(依不同配置)。
从表中数据可以发现,从650μL至50μL所检测的不同体积中,所得到的每毫升的颗粒数基本相同,其RSD值在50uL处依旧维持在2.4%,可见AccuSizer系列仪器在微量进样的技术层面,依然可以提供精确的数据。
4.2 宽高浓度适应能力
AccuSizer系列颗粒计数器专为高浓度样本的检测提供解决方案。其独特的设计理念特别适合高浓度样本,搭配自动稀释模块更是可以检测浓度高达1012#/mL的样本。这使其适用于颗粒浓度变化较大的疫苗样品,包括部分乳佐剂制剂。
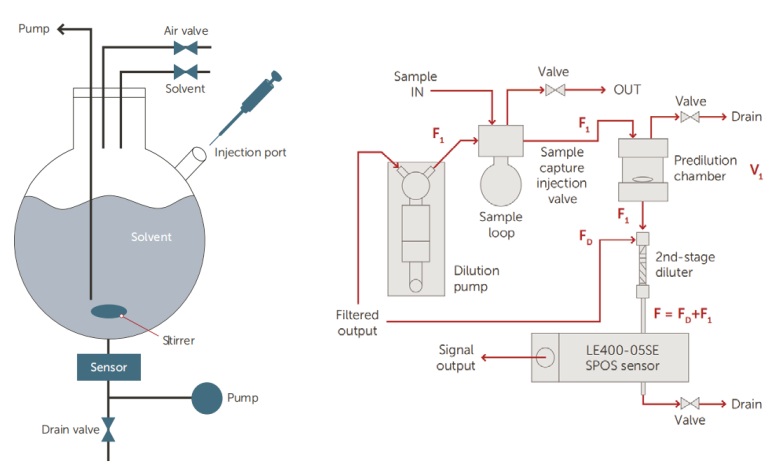
图 12:自动稀释系统原理图 图13:二步稀释系统原理图
如图14所示AccuSizer系列颗粒计数器(分别应对LE、FX、Fxnano传感器)测试数据结果,A7000 APS结果图(LE传感器)浓度高达: 3.72E+007 颗/mL。
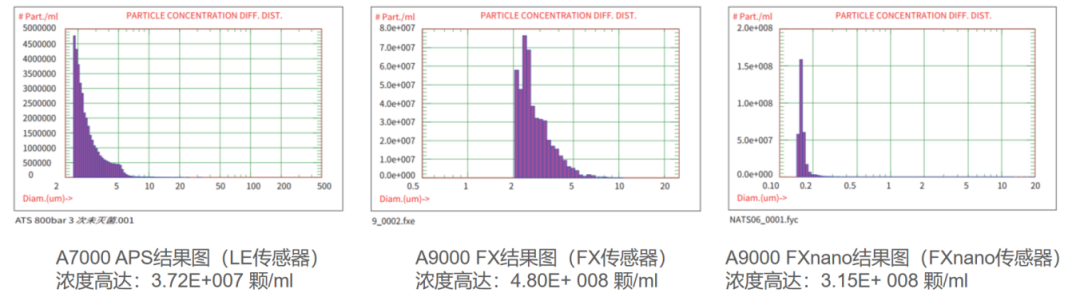
图14:AccuSizer系列(分别应对LE、FX、Fxnano传感器)测试数据结果
4.3 测试结果准确可靠
在高蛋白、高盐或乳化剂复杂体系中,AccuSizer通过单颗粒光学传感计数(Single Particle Optical Sizing,SPOS),可实现对分散体系中的不溶物微粒量化计数,减少配方干扰导致的假信号。这对于保证结果准确性和重复性至关重要。
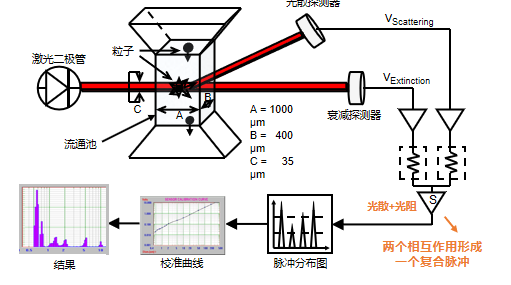
图15:SPOS原理图
4.4 符合国际法规
AccuSizer测量结果重复性高,可追溯性强,符合国内外药典(如USP<788>及中国药典2025版)对亚可见颗粒检测的要求,可用于批次间对比和质量控制,为疫苗研发和生产提供可靠的数据支持。
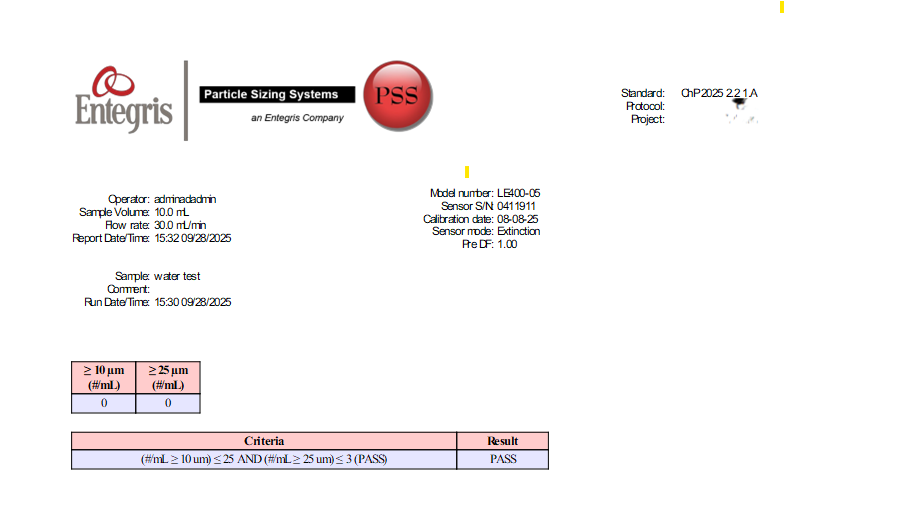
图16:CP0903 检测报告

图17:USP788 检测报告
4.5 AccuSizer颗粒计数器系列
AccuSizer系列颗粒计数器通过搭配不同传感器、进样器,适配不同的样本的测试需求,能快速而准确地测量颗粒粒径以及颗粒数量/浓度的卓越伙伴。
 |
 |
|
AcuSizer A7000 APS |
AcuSizer A7000 SIS |
|
检测范围:0.5μm-400μm |
检测范围:0.5μm-400μm |
|
采用全自动二步稀释结合定量环进样,封闭式检测空间,一体化检测流程。实现了真正的单接口,一站式检测,操作简便,测试结果稳定可靠。
|
可根据样品特性,选配不同的进样系统。不仅可以检测常规液体样本,升级后可检测油品样本。 |
|
应用: 医药(乳剂、脂质体)半导体(CMP Slurry)、墨水等。
|
应用: 光电材料(PI、光刻胶)、IVD、净水、墨水、过滤、精密加工等。
|
 |
 |
|
AcuSizer A7000 AD
|
AcuSizer A9000 FXnano-AD聚焦光束纳米颗粒计数器
|
|
检测范围:0.5μm-400μm
|
检测范围:0.15μm-200μm 样品浓度:1012个/mL
|
|
采用自动稀释模式,可以有效将高浓度样品快速稀释至合适浓度并进行检测。针对易沉降颗粒,采用meter pump抽样模式,优先识别更大颗粒,确保检测准确,完整可靠。
|
采用光学聚焦技术,对纳米级别的微粒进行颗粒计数,加载自动稀释模块,对极高浓度样本进行检测,在半导体研磨液(Slurry)中大量采用。 |
|
应用: 医药原料药、混悬剂、微球、造影剂微泡)、SiC金刚石研磨液,墨水、3D打印材料,电池浆料等。 |
应用:高端制程CMP研磨液,纳米气泡,过滤等。 |
总结
疫苗中的亚可见颗粒是影响其安全性与有效性的关键质量属性。无论是蛋白质抗原的聚集体、乳佐剂的粒度分布,还是包材引入的外源性微粒,均需进行精准监控。AccuSizer系列颗粒计数器凭借其宽检测范围、高灵敏度及符合国际标准的检测方法,能够在疫苗研发、生产、质控和稳定性研究的各个阶段发挥作用。未来,随着疫苗平台的不断更新和监管要求的日益严格,AccuSizer将在全球疫苗行业中继续发挥重要作用,为提升公共卫生安全提供技术保障。
参考文献
[1]
[2] Sharma DK, King D, Oma P, Merchant C. Micro-Flow Imaging: Flow Microscopy Applied to Sub-Visible Particulate Analysis in Protein Formulations. AAPS J. 2010;12(3):455–64.
[3] European Pharmacopoeia. Sub-visible particulate contamination: Ph. Eur. 10.0, 2.9.19. 2020.
[4] Wang W. Protein aggregation and its inhibition in biopharmaceutics. International Journal of Pharmaceutics. 2005;289(1-2):1–30.
[5] Novartis AG. WO2011067669A2
[6] 王珏,江颖,沈雁,等.基于小鼠腘窝淋巴结模型对疫苗用辅料蔗糖中不溶性微粒激发免疫应答风险的评估[J].药物生物技术,2022,29(03):234-238.
[7]彭姝,张军,李慧芬等.输液中不溶性微粒的危害综述[J].中国药事,2018,32(08):1058-1063.
[8] Rosenberg AS. Effects of protein aggregates: an immunologic perspective. AAPS J. 2006;8(3):E501–E507.
[9] 周雅洁,聂建辉,黄维金,等.国内外疫苗批签发管理概述[J].中国食品药品监管,2025,(02):92-103.
[10] 崔晓雨,李薇,权娅茹,等.麻腮风联合减毒活疫苗2014~2016年批签发质量分析[J].中国生物制品学杂志,2017.
[11] USP <788>. Particulate matter in injections. 2023.
[12] 中国药典2025版. 注射剂不溶性微粒检测要求.







