上海奥法美嘉生物科技有限公司代理商
10 年
手机商铺
- NaN
- 0.5
- 0.5
- 2.5
- 2.5
推荐产品
公司新闻/正文
复杂制剂应用专题 | 纳米脂质注射剂的表征与解决方案
7 人阅读发布时间:2026-01-16 14:15
一、脂质体粒径控制的重要性
纳米脂质体(nanoliposomes)是一种具有类细胞膜磷脂双分子层的纳米囊泡体,因为磷脂层与细胞膜的结构类似,可以与细胞膜融合,从而将药物送入细胞核中。脂质体载体独特的释药机制,使其不但可以增加药物溶解度,还具有潜在的缓释或靶向特性,广受研发人员的青睐,全球范围内已有 10 余种注射用脂质体产品获批上市。
纳米药物与其他药物一样,必须具有安全性、可控性与有效性,有效性是纳米药物实现疾病治疗的基础。脂质纳米注射剂经给药在体内运转时,需要克服多重生理/病理屏障,才能安全到达靶点发挥治疗作用,在发挥其药效前需要克服血液、组织、细胞和细胞器等多重屏障[1]。通过调控纳米药物本身的物理化学性质,如纳米药物的大小、形状、表面电荷的等,一定程度上能够克服药物递送障碍[2]。
相比于传统注射剂,脂质体具有靶向作用,可减轻药物的毒副作用,机体器官对不同粒径微粒的阻留能力不同,可通过脂质体注射剂的粒径控制实现药物被动靶向效果[3]。以脂质体粒径小于50nm时一般都能够靶向至脾组织;在50~100nm时能靶向至肝组织;在0.1~0.2μm时能够靶向至肝组织肝巨噬细胞的溶酶体;在7~12μm时可被肺组织细胞摄取;>12μm时能够被毛细血管上皮细胞摄取进而到达荷瘤组织内;>15μm时能被肠系膜动脉等血管上皮细胞摄取[4]。
脂质体的粒径直接影响药物的释放、生物利用度,载药量、靶向性等,在制备时应控制粒子的大小,获得较窄且均匀的粒度分布。
二、脂质体药物制备方法
脂质体的制备流程图见图1,薄膜分散法、溶剂注入法、逆向蒸发法、微流控技术制备得到的是粒径比较大的粗脂质体,在除去有机溶剂后,还需要通过高压均质薄膜挤出进行整粒及超滤进行纯化,才得到粒径均一、满足使用安全要求的脂质体。脂质体的平均粒径和粒度分布是脂质体药品关键质量属性,显著影响其体内行为。溶解磷脂可能需要用到毒性比较大的有机溶剂,溶剂残留需要符合ICH相关规定,除去可能存在困难。超滤是影响粒径和溶剂残留的关键工艺,也是达到控制的最后一步工艺[5]。
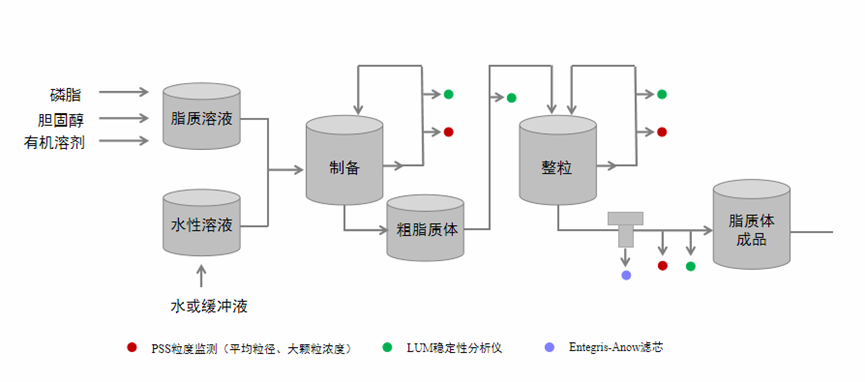
图1 脂质体制备与表征流程图
三、脂质体粒度控制
脂质体给药系统属于非均相热力学不稳定系统,脂质体在制备过程中,若粒径大小及分布不合格,则会影响产品后续质量问题。粗脂质粒需要经过高压均质或微射流进行整粒,而后进行超滤纯化,得到粒径均一的脂质体。高压微射流均质机具有大规模、连续化生产等特点,通过高速撞击、剪切与空穴作用达到均质与细化的目的,现已有用于制备阿糖苷、中链脂肪酸、茶多酚及维生素C等纳米脂质体的实例[6]。
3.1 高压微射流均质机
PSI-20高压微射流均质机(小试兼中试型)采用固定结构的均质腔,通过电液传动的增压器使物料在高压作用下以极大的速度流经交互容腔的微管通道,物料流在此过程中受到高剪切力、高碰撞力、空穴效应等物理作用,使得平均粒径降低、体系均一稳定,由此获得理想的均质、分散、去团聚的结果。

图2 高压微射流均质机
-
最高2069 bar的均质压力,最高处理量20L/h (PSI-20)
-
采用特殊设计Y型腔,去除尾端大颗粒效果佳,物料的混合更均一,处理效率高
-
屏显界面,数据可溯源:支持数据导出设定压力及实时压力、监测点温度、实时流量、时间等
-
配置K型热电偶:可用于实施监测料液温度
-
低噪音:运行音量低于70分贝,工作环境友好型
四、平均粒径与Zeta电位检测
脂质体理化性质评价通常包括粒径大小及分布均匀程度、稳定性及包封率等方面。粒径大小及分布除与其包封率及稳定性有关外,同时对载药脂质体的治疗效果有直接的影响。因物理和生理作用,机体能够选择性地在肝、脾、肺、淋巴等部位聚集不同大小的载药脂质体,从而使其释放药物发挥药效。[7]此外,还可以通过检测Zeta电位对脂质体稳定性进行评价,Zeta电位越高,体系更加稳定。
4.1 Nicomp纳米激光粒度仪系列
Nicomp系列纳米激光粒度仪采用动态光散射原理检测分析样品的粒度分布,基于多普勒电泳光散射原理检测ZETA电位。

图3 Nicomp N3000系列
-
粒径检测范围0.3nm-10μm,ZETA电位检测范围为+/-500mV
-
搭载Nicomp多峰算法,可以实时切换成多峰分布观察各部分的粒径。
-
高分辨率的纳米检测,Nicomp纳米激光粒度仪对于小于10nm的粒子仍然现实较好的分辨率和准确度。
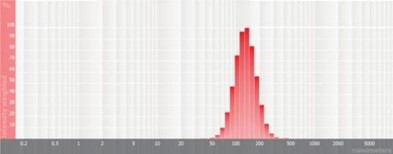
图4 高斯粒径分布图
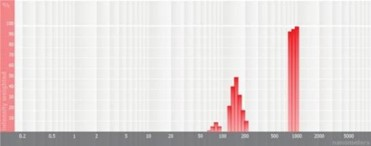
图5 多峰粒径分布图
4.2 NICOMP 3000系列用于脂质体粒径检测案例
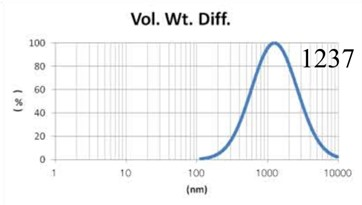
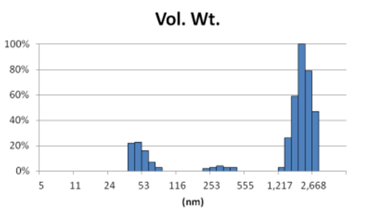
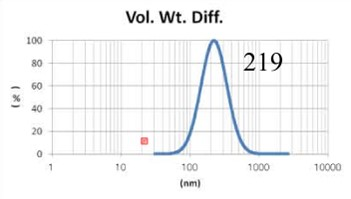
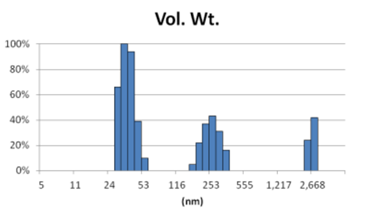
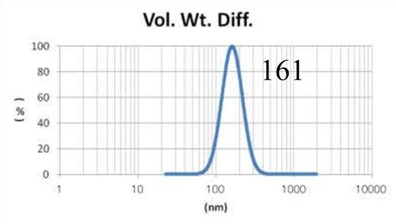
采用GMV(giant multilamellar vesicle):Sugar-doped lipid-film hydration(脂膜水化反法)方式制备脂质体,对过滤挤出工艺前后样本脂质体用Nicomp 3000设备进行粒度检测,测试结果如表1所示。
表1 GMV法制备脂质体过滤前后粒径分布图
|
Before Extrusion (Gaussian分布) |
Before Extrusion (Nicomp分布) |
 |
 |
|
After Extrusion through 0.4um Filter(3 times)(Gaussian分布) |
After Extrusion through 0.4um Filter(3 times)(Nicomp分布) |
 |
 |
|
After Extrusion through 0.2um F ilter (3 times)(Gaussian分布) |
After Extrusion through 0.2um Filter(3 times)(Nicomp分布) |
 |
 |
|
After Extrusion through 0.1um Filter (3 times)(Gaussian分布) |
After Extrusion through 0.1 um Filter(3 times)(Nicomp分布) |
 |
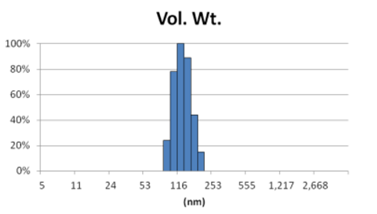 |
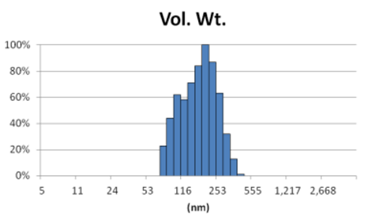
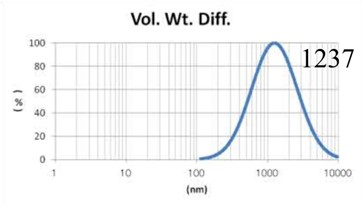
由表1可知,没有过滤挤出前Gaussian分布下平均体积径为1237nm;经过0.4um、0.2um、0.1um过滤器过滤挤出3次后,平均体积径为219mm、161nm、101nm;平均粒径明显降低。通过Nicomp分布可真实反映脂质体粒径分布情况,由表1 Nicomp分布可知,未挤出脂质体体积粒径Nicomp分布有三个峰;经过0.4um过滤器挤出后三个峰的粒径均减小,经过0.2mm过滤器过滤之后变为单峰,经过0.1um过滤器过滤之后获得分布更加窄的单峰。
对比Gaussian及Nicomp分布结果可知:Gaussian分布可整体反应脂质体粒径分布情况:而Nicomp分布更真实反映脂质体粒径分布。通过Nicomp数据的分析可以更好的帮助脂质体制备工艺的优化,选择合适的处理方式得到想要的粒径范围样本。
五、尾端大颗粒和小粒子的检测
用作载药功能的脂质体平均粒径一般为亚微米级别或纳米级别,但仍存在微米级别的脂质体粒子,尾端大颗粒的存在往往会吸附小颗粒,影响脂质体的稳定性,分析尾端大粒子浓度和数量可以评价当前配方和工艺的情况并做出相应优化,例如用作佐剂的脂质体一般检测0.8um~10um之间的大颗粒分布,以确保工艺的稳定。药典中对于中长链脂肪乳要求从1.8um开始监测大颗粒,关注5~50um大乳粒。而在几年前的FDA PF文件中提及,建议脂质体的粒度控制参考药典中对于长链脂肪乳要求。此外,为确保纳米药物的有效性,还需控制小粒子的浓度,过小的脂质体粒子容易被肾脏清除到尿液排出,无法起到治疗作用[8]。
5.1 AccuSizer颗粒计数器系列
AccuSizer系列在检测液体中颗粒数量的同时精确检测颗粒的粒度及粒度分布,通过搭配不同传感器、进样器,适配不同的样本的测试需求,能快速而准确地测量颗粒粒径以及颗粒数量/浓度。

图6 AccuSizer A7000系列
-
检测范围为0.5μm-400μm(可将下限拓展至0.15μm)
-
0.01μm的超高分辨率,AccuSizer系列具有1024个数据通道,能反映复杂样品的细微差异,为研发及品控保驾护航
-
灵敏度高达10PPT级别,即使只有微量的颗粒通过传感器,也可以精准检测出来
5.2 AccuSizer系列用于脂质体粒径检测案例
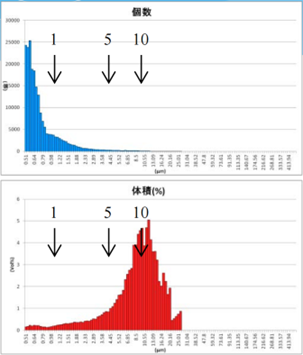
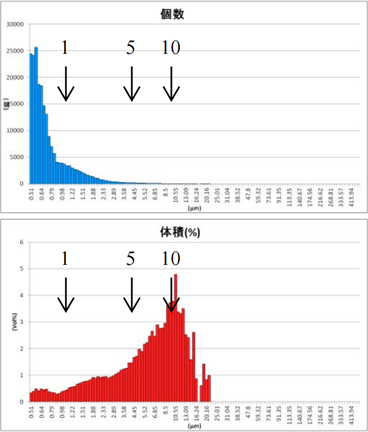
采用GMV(giant multilamellar vesicle):Sugar-doped lipid-film hydration(脂膜水化反法)方式制备脂质体,对过滤挤出工艺前后样本脂质体用AccuSizer A7000设备进行粒度检测,测试结果如表2所示。
表2 GMV法制备脂质体过滤挤出后粒径分布图
|
Afler Centrifugation |
After Extrusion through 10.0um Filter (1 time) |
 |
 |
|
After Extrusion through 5.0um Filter (1 time) |
After Extrusion through 3.0um Filter (1 time) |
 |
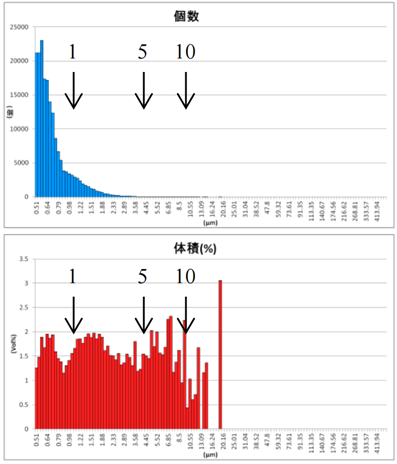 |
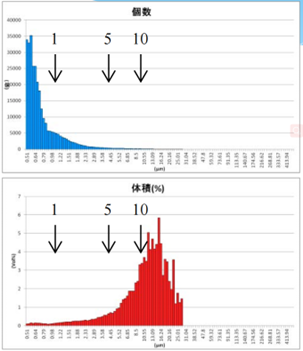
由表2可知,上面蓝色谱图为数量粒径分布结果,下面红色谱图为体积粒径分布测试结果。分别对制备的脂质体样品用10um、5um、3um过滤器过滤,经过10um、5um、3um过滤器的数量粒径分布比未过滤前浓度更低,但数量粒径分布差异不大;观察体积粒径分布,可知:经过10um、5um过滤器过滤后,体积占比中大于等于10um颗粒明显减少;经过3um过滤器过滤后,10um颗粒体积占比进一步减少,且主峰已不在10um处,尾端大颗粒明显减少。
六、稳定性分析检测
稳定性是评估药物的常规项,脂质体稳定性影响存放时间和有效期,稳定性较差的脂质体会导致药物疗效降低或副作用增加,有的药物甚至产生有毒物质。控制尾端大粒子数量和浓度能有效提高脂质体的稳定性,此外,粒径分布较窄的脂质体稳定性也较好。
6.1 LUM稳定性分析仪
LumiFuge稳定性分析仪可以直接测量整个样品的分散体的稳定性,检测和区分各种不稳定现象,如上浮、絮凝、聚集、聚结、沉降等,通过测量结果可用来开发新的配方和优化现有的配方及工艺。

图7 LUM稳定性分析仪
-
快速、直接测试稳定性,无需稀释,温度范围宽广。
-
可同时测8个样品,测量及辨别不同的不稳定现象及不稳定性指数。
-
加速离心,最高等效2300倍重力加速度。
七、过滤
粗脂质体经高压微射流等设备整粒之后,需经过超滤才能得到最终的脂质体成品。超滤是以压力为推动力的膜分离技术之一,优点是没有相转移,无需添加任何强烈化学物质,可以在低温下操作,过滤速率较快,便于做无菌处理等。超滤技术的关键是滤膜,滤膜有各种不同的类型和规格,综合考量物理拦截,吸附拦截等效果,选择适配的滤膜材质用于过滤。
7.1 Entegris滤芯
Entegris-Anow是一家高分子微孔膜过滤企业,专业从事MCE、Nylon、PES、PVDF、PTFE等(膜孔径为0.03μm~10μm)微孔膜的研发及生产,具有二十多年服务与医药客户经验,并为全球生物制药、医疗器械、食品饮料、实验室分析、微电子及工业等领域的客户提供过滤、分离和净化解决方案。
Entegris与Anow的结合,引入Entegris质量管理体系,每一支滤芯都经过严格检查,此外,新建成的CTC验证中心,为全球客户提供专业的验证服务。

图8 Entegris 滤芯







